大连化学物理研究所赵宗保研究员团队(生物质高效转化研究组1816组)王雪颖、郭潇佳和大连理工大学冯延宾等在非天然辅酶领域再获新突破。近期,该团队创制了可利用细胞内源CTP和NMN原位合成NCD的NCD合酶(NcdS),构建了NCD自给平台菌株,并成功构建高选择性物质代谢途径。相关成果发表在国际知名期刊Nature Communications上:Creating enzymes and self-sufficient cells for biosynthesis of the non-natural cofactor nicotinamide cytosine dinucleotide。

为突破调控天然辅酶的局限,赵宗保研究团队近十余年来致力于创建和应用基于非天然辅酶的生物正交代谢体系。前期工作中,该团队通过交叉筛选获得了偏好人工辅因子烟酰胺胞嘧啶二核苷酸(nicotinamide cytosine dinucleotide, NCD)的苹果酸酶突变体,成功构建依赖于NCD的正交氧化还原体系,并将NCD关联的氧化还原配对拓展至亚磷酸脱氢酶、乳酸脱氢酶、甲酸脱氢酶等氧化还原元件;通过解析晶体结构,揭示了辅酶偏好性改变的分子基础;以大肠杆菌为宿主,通过表达核苷酸转运蛋白和NCD偏好型氧化还原酶,成功实现NCD介导的高选择性能量传递。然而,微生物难以从环境中有效摄取NCD,亟需解决胞内NCD供给问题。
在构建NCD自给平台菌株,并构建高选择性物质代谢途径中研究人员做了三方面的重要工作:
一、以来源于大肠杆菌的NAD合成途径关键酶—烟酸腺嘌呤单核苷酸转移酶(NaMNAT)为模板,对其进行定向进化。对NaMNAT的天然底物ATP和烟酸单核苷酸(NaMN)的两个结合口袋进行半理性设计及改造,获得了独立偏好利用胞嘧啶核苷三磷酸(CTP)和烟酰胺单核苷酸(NMN)的突变体。进一步将影响两个结构域偏好性的关键氨基酸进行组合,获得可同时利用CTP和NMN合成NCD的NCD合酶(NcdS),其合成NCD的偏好性较NaMNAT提高1.30×1011倍,可直接利用细胞内源CTP和NMN合成NCD。
二、在此基础上作者同时表达CTP合成酶CtCTPS*和NMN合成酶FtNadE构建NCD合成模块,并将该模块用于不同大肠杆菌株系中,均获得稳定的NCD自给表型,胞内NCD最高可达5.0 mM,超过天然辅酶NAD水平—创制了NCD合酶及NCD自给平台菌株。
三、进一步的,研究人员在NCD自给平台菌株中引入NCD依赖型苹果酸酶突变体和乳酸脱氢酶突变体,发现NCD(H)可选择性驱动L-苹果酸转化生成D-乳酸,转化率提高4倍。
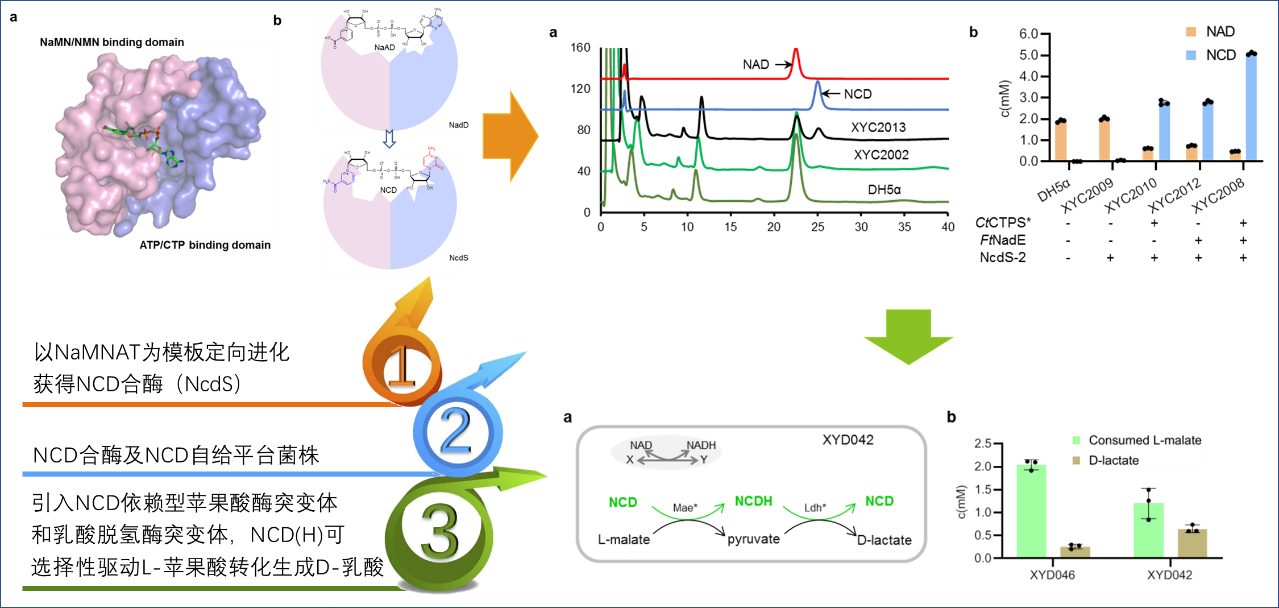
赵宗保研究团队创制的NCD合酶及NCD自给平台菌株,有助于在代谢水平进行正交氧化还原途径调控,为化学生物学和合成生物学提供新工具;同时,非天然辅酶自给工程菌将与非天然碱基和非天然氨基酸一起扩大我们对生命的理解和重编程能力。
能源生物技术平台在此工作中提供了有力支撑:
1. 高通量细胞培养与活性分析系统应用在本文及前期多种酶的定向进化工作中,降低劳动强度,加快筛选速度。
2. 蛋白层析纯化系统是获得高纯度蛋白的得力助手。
3. 蛋白结晶筛选纳升级液体工作站在蛋白质晶体结晶过程中提供精准的样品滴加操作,加快蛋白结晶条件的筛选工作。
